中心法则是分子生物学的基础理论之一,它描述了遗传信息在生物体内的传递和表达过程。根据这一法则,遗传信息的传递一直遵循着DNA→RNA→蛋白质这个线性框架;此后,病毒中逆转录酶的发现补充了中心法则,证明生物体内也能实现RNA→DNA的逆向流动。
而今,科学家们发现了一种颠覆式的现象:细菌的一种逆转录酶可以利用非编码RNA创造出全新的编码DNA。这项研究揭示了生物体遗传信息传递的多样性,强调了基因组非编码基因的编码潜力,打破了传统法则中只能沿基因组DNA线性方向编码遗传信息的范式。
近日,哥伦比亚大学的科学家Stephen Tang和Samuel H. Sternberg团队在 Science 上发表了题为“De novo gene synthesis by an antiviral reverse transcriptase”的最新成果,研究以肺炎克雷伯菌为研究对象,揭示了一种由DRT2(defense-associated reverse transcriptase 2)防御系统介导的抗病毒防御机制。

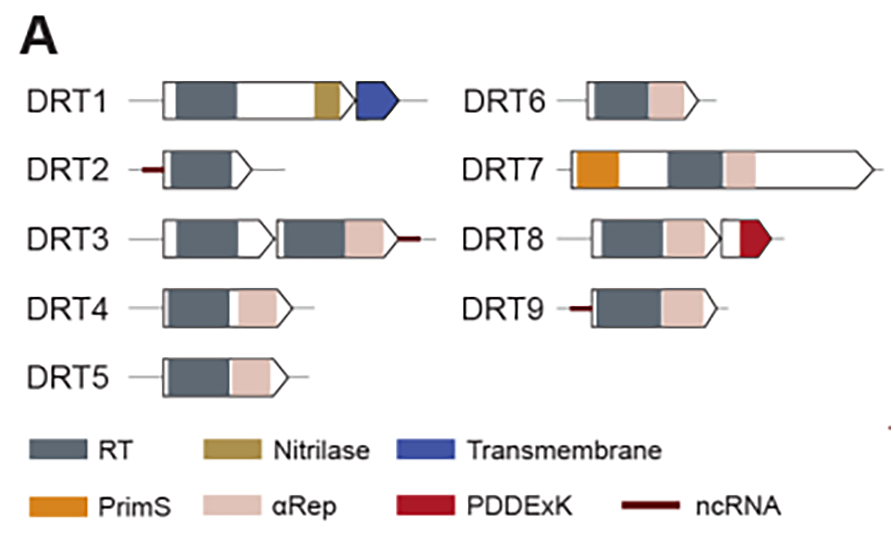
防御相关逆转录酶(Defense-associated Reverse Transcriptase, DRT)是细菌中除RT-Cas1和retron外的第三类具有抗噬菌体功能的逆转录系统,被划分为9个亚组(DRT1-9)。DRT系统中逆转录元件具有单基因操纵子的特征,这意味DRT系统可能仅依靠逆转录功能实现了噬菌体防御。但在此之前DRT系统中cDNA产物功能及免疫机制都是未知的。
该研究聚焦于肺炎克雷伯菌的DRT2系统(KpnDRT),因为该亚族系统结构简单,仅由单个编码逆转录酶(Reverse Transcriptase,RT)的开放阅读框(ORF)及其上游的非编码RNA(non-coding RNA,ncRNA)构成,后者此前未发现具有确切功能。与其它DRT系统或retron系统不同,DRT2系统缺乏额外的蛋白质编码基因,并且RT仅具有RNA导向DNA聚合酶的结构域,也没有预测到除此以外的其它功能结构域。因此研究人员提出1个假设:逆转录酶合成的cDNA产物可能在DRT2免疫机制中起着关键、核心作用。
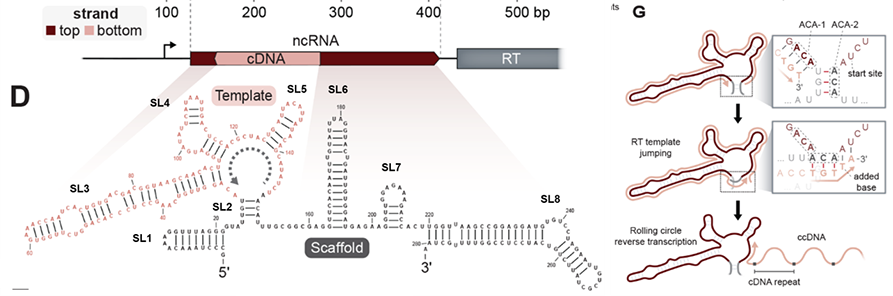
DRT2系统中ncRNA链的碱基之间互补配对,折叠形成一个具有很多保守茎环(stem-loop,SL)的二级结构,其中由SL2短茎连接的、具有较大3’区域的RNA区域是RT合成cDNA的模板。RT以SL2相邻区域的UCU作为起始位点,沿着模板区域3’→5’方向移动。回到SL2区域时,RT“跃过”SL2环状结构再次移动到起始位点UCU,继续进行下一轮的逆转录。这种独特的机制导致了cDNA片段不断串联累加,形成了串联多个重复序列的cDNA,最长可达到40个重复。研究者将这一现象称为滚环逆转录(rolling-circle reverse transcription,RCRT),类似于DNA的滚环复制。
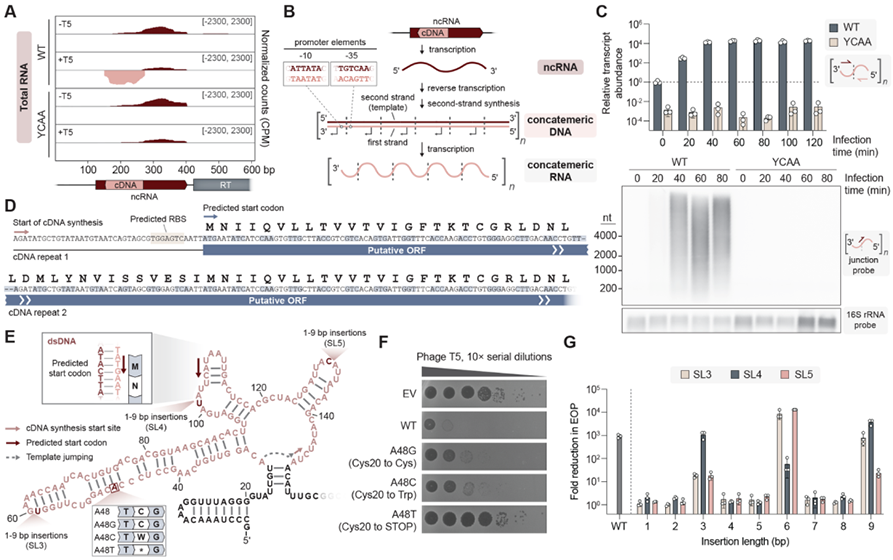
有趣的是,细菌被T5噬菌体感染后,体内除了ncRNA逆转录的cDNA外,还会出现大量与ncRNA链性相反、包含多个重复的RNA序列,可达到未感染细菌的~10000倍。随后实验结果也表明合成的cDNA互补链可能是RNA聚合酶另一轮转录的模板链,所得转录本将具有与初始ncRNA相反的链性,并可以包含不同数量的cDNA重复序列。那么串联的重复cDNA转录形成的RNA在抗噬菌体免疫反应中又有着怎样的作用呢?利用算法预测,单个cDNA具有一种没有任何终止密码子的ORF区域。RCRT在每次“跳跃”时会增加1个额外碱基,产生了1个120bp的cDNA重复单元,该重复单元恰好包含40个正义密码子。这种重复单元确保了每次串联复制中ORF的完整性,并产生了连续的ORF。令人惊奇的是,一个cDNA重复单元的末端与下一个cDNA重复单元的起始端形成了1个全新的启动子,具有典型的-10和-35区域。至此,这些基于RCRT机制产生的串联重复cDNA形成了1个全新的编码基因,并且ORF内没有任何终止密码子,研究者们将其命名为Neo(never-ending ORF)。
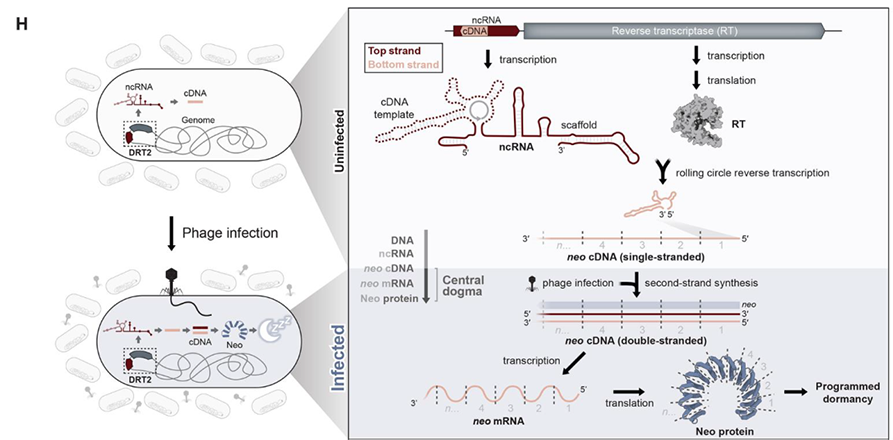
进一步的蛋白表达实验证实,当串联的cDNA重复数等于或大于3时,neo基因编码的蛋白质会诱导宿主细胞通过关闭代谢过程来阻止噬菌体复制,并进入程序性休眠,从而中断病毒的传播过程。根据KpnDRT2产生Neo蛋白的机制信息,研究者们进一步在DRT2同源物中分析这种免疫机制内部基因合成策略的进化保守程度。分析确认了绝大多数物种都具有与KpnDRT2相关的ncRNA和Neo蛋白,结果表明这种独特防御机制具有广泛的保守性。值得注意的是,对于Neo蛋白合成和表达至关重要的序列,如“跳跃”过程中的ACA-1、ACA-2以及串联重复中的启动子元件,在其它的同源物中也具有极高保守性。


该研究揭示了KpnDRT2防御系统介导的一种前所未有的抗病毒免疫机制。在未感染时,细菌KpnDRT2防御系统中的ncRNA和RT由单个启动子组成型表达,通过介导RCRT过程精准、程序化“跳跃”合成具有异质性大小的、重复的单链cDNA。噬菌体感染后,cDNA第2链合成被触发,从而导致串联重复的双链cDNA大量积累。随后,相邻cDNA连接处新形成的启动子招募RNA聚合酶,大量表达异质性大小的mRNA,这些mRNA可以编码一类无终止密码子、永无止境的ORF(neo)。进一步地,Neo蛋白通过阻止细胞生长和诱导程序性休眠来保护细菌种群免受噬菌体的传播和侵染。
这项研究阐述了一种新颖的基于DRT2系统的抗病毒免疫机制,这种机制证明了遗传信息DNA和RNA两种载体之间遗传信息传递的复杂性,拓展了我们对中心法则的认知。同时,Neo蛋白的发现打破了蛋白编码基因定义的传统特征,也引发我们对基因组组成的更广泛思考。以人类基因组为例,仅有~1.5%的基因组序列被认为是蛋白质编码基因,那么剩余的98.5%基因组序列是否还有更多类似于Neo蛋白的非典型蛋白质编码基因?我们觉得答案是肯定的。多久后能够出现基于DRT系统的新基因工具,又是否能够像CRISPR/Cas系统一样给生物学带来巨大的变革,令人期待。
关于我们
豪利777生物致力于成为合成生物学赋能技术领导者!领先的设计和先进的制造工艺为全球研究人员、科学家、合成生物学家和药物开发者提供DNA“设计—构建—测试—学习”一体化解决方案。

l 核酸合成平台
凭借自主研发的Syno®合成平台,精准合成各类所需的DNA和RNA序列,无论是编码特定蛋白质的基因、构建基因编辑载体还是制备RNA产品,我们都能实现您的定制化需求。利用先进的合成技术,我们保证高纯度、高产量的核酸产品,以及严格的质量控制流程确保每一位客户的订单都达到最高标准。
l 重组蛋白表达平台
凭借深厚的蛋白相关经验,构建了涵盖大肠杆菌、酵母、昆虫和哺乳动物细胞四大蛋白表达平台,每年为全球客户供应数千种重组蛋白/抗体。我们根据蛋白特性与客户要求,精准选择表达载体、宿主和融合标签,实现定制化服务。此外,我们提供10L至500L的发酵罐生产服务,满足从毫克到克级的生产需求,为客户大幅节省经济和时间成本。
参考文献
Stephen Tang et al. De novo gene synthesis by an antiviral reverse transcriptase. Science 0, eadq0876 DOI:10.1126/science.adq0876
 Syno®C 引物合成
Syno®C 引物合成 RNA合成
RNA合成 mRNA合成
mRNA合成 Syno®GS 基因合成
Syno®GS 基因合成 载体构建
载体构建 高通量及DNA文库构建
高通量及DNA文库构建 CRISPR基因编辑平台
CRISPR基因编辑平台 病毒包装
病毒包装 基因测序及分析
基因测序及分析 重组蛋白表达平台
重组蛋白表达平台 抗体工程平台
抗体工程平台 多肽服务
多肽服务 生物信息学分析与设计
生物信息学分析与设计 CRISPR文库
CRISPR文库 ProXpress蛋白快速检测
ProXpress蛋白快速检测 CRISPR 质粒
CRISPR 质粒





















